La surveillance et le contrôle en temps opportun des paramètres de procédés et attributs de produit critiques (CPP et CPA) sont essentiels pour concevoir, analyser et contrôler un bioprocédé.

La surveillance et le contrôle en temps opportun des paramètres de procédés et attributs de produit critiques (CPP et CPA) sont essentiels pour concevoir, analyser et contrôler un bioprocédé.

Comme lors des étapes amont de cultures, le passage à l’usage unique dans les étapes de purification avales est de plus en plus observé pour des raisons évidentes de simplicité d’utilisation et de gain de productivité.

La pandémie que nous traversons et le confinement passé ont bouleversé nos vies professionnelles. En quelques jours, voire quelques heures, il a fallu repenser une stratégie, redéfinir une organisation, re-appréhender les espaces de travail et les déplacements ou encore s’équiper pour le télétravail.

La multiplication des données générées dans les procédés biotechnologiques et pharmaceutiques ainsi que la volonté de plus en plus présente d’une démarche PAT - Process Analytical Technology - a contraint les entreprises à adopter de nouvelles méthodes pour la gestion de ces flux continus d’informations.
Le data-management est alors entré en jeu ainsi que la notion de logiciel PIMS - Process Information Management System.

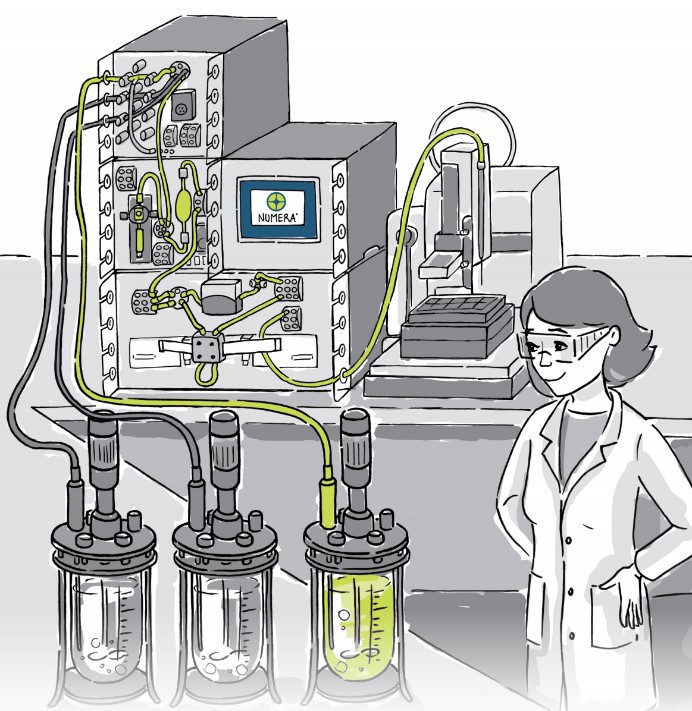
Aujourd’hui, très peu de laboratoires intègrent des capteurs de débit non intrusifs dans leurs étapes de filtration et purification. Pourtant ceux-ci présentent 3 avantages majeurs :

En accord avec les directives ICH Q8 de la production pharmaceutique et plus particulièrement celles concernant les milieux de culture, les composants de ces derniers doivent être clairement identifiés, définis, contrôlés et enregistrés. Chaque matière première entrant dans la fabrication d’un produit d’intérêt doit être analysée et quantifiée. Il en est de même pour les additifs ajoutés en cours de procédé. Cette traçabilité est primordiale car des variations durant la préparation des milieux peuvent affecter la qualité du produit final ou sa productivité.

Comment intégrer dans un laboratoire R&D la totalité des tâches en relation avec un procédé, de la préparation et l’enregistrement des ingrédients des milieux de culture à la programmation des recettes, en passant par l’intégration d’un plan d’expérience ? Autant de questions auxquelles le logiciel Lucullus PIMS dans sa version Advanced et Expert peut répondre en proposant un seul et même logiciel pour gérer votre flux de travail dans sa globalité.

L’étape terminale de la production d’un médicament ou vaccin consiste à « libérer le lot ». Derrière cette formule simple se cache un système strict et très réglementé d’assurance qualité. Ce dernier, dont la réglementation est étroitement contrôlée par les autorités de santé, est l’organe qui rend la décision finale sur la qualité du lot produit. Il s’assure de la correspondance entre le produit fini et le cahier des charges, décrit dans les modules 2 et 3 du dossier d’autorisation de mise sur le marché et dans le certificat de conformité délivré par les autorités de santé. En France, la libération d’un lot est subordonnée à l’approbation du pharmacien responsable, qui rend son avis après consultation du bulletin d’analyse du lot. On comprend aisément que ce document est loin d’être anodin et que sa rédaction doit être réalisée avec le plus grand soin.

Depuis quelques années, l’industrie pharmaceutique est soumise à de forts changements de son activité : ralentissements de la productivité, fin de brevets de plus en plus nombreux, pression toujours plus importante sur le prix des produits de santé… Cette pression est due, majoritairement, à deux facteurs : l’augmentation des coûts (R&D, production, qualité, …) et la concurrence toujours plus forte du fait des « génériqueurs », que les produits soient conventionnels ou issus des biotechnologies.

L’ère du Big Data a eu un impact déterminant sur la gestion de la qualité des produits de santé, plus particulièrement pour les biomolécules et autres produits de biotechnologies, et a permis un complet changement de paradigme dans la conception et la gestion des procédés de fabrication.
Le « Quality by Design », élément clé du big data
De là découle directement le concept de « Quality by Design »1 ou QbD, concept défini dans les directives des autorités de santé (EMA, FDA et ICH Q8(R2) et Q11) comme « une approche systématique du développement d’un médicament, permettant, sur la base des connaissances scientifiques (Knowledge Management), d’optimiser la qualité des produits et de leur procédé de fabrication ».
Page 1 sur 2
System-c bioprocess
2, allée de Chamillé
ZI du Bois des Lots
26130 Saint-Paul-Trois-Châteaux
France
+33 4 75 54 86 00
bioprocess@systemc.pro