Les bioprocédés ont connu ces dernières années un essor considérable dans la réduction des échelles avec la mise sur le marché de systèmes de cultures et de bioréacteurs aux volumes toujours plus petits, générant toujours plus de données.
Si leur intérêt n’est plus à démontrer pour ces applications, qu'en est-il pour les procédés de thérapies innovantes ?
Le développement de ces procédés de thérapie cellulaire et génique est aujourd’hui beaucoup plus limité par les outils mis à disposition. Avec des cellules de donneur/patient coûteuses, rares et variables, il est difficile de développer un modèle réduit qui fournisse suffisamment de données utiles.
L’arrivée très récente de nouvelles technologies de miniaturisation dans ces domaines représente une véritable révolution et permet aux chercheurs d’avoir des systèmes capables d’établir un procédé de fabrication plus robuste, mieux compris, d’effectuer plus d'expériences de développement en moins de temps et ce à très petits volumes – 2mL !
Les problématiques actuelles rencontrées dans le développement des thérapies cellulaires
Toujours plus vite !
Le temps est un élément central dans le développement des procédés, souvent réduit à son minimum, pour une réalisation clinique dans les plus brefs délais.
Pourtant, chaque procédé est unique pour chaque thérapeutique et nécessite une optimisation importante.
Les autorités de contrôle retardent les produits en raison des CMC (Chemistry, Manufacturing and Controls) et les chercheurs ont ensuite une fenêtre étroite lors de l’essai en phase clinique 1 pour améliorer le procédé avant la phase clinique 2. Ceci est d’autant plus vrai si la désignation RMAT (Regenerative Medicine Advanced Therapy) est obtenue.
Des procédés manuels et complexes
Que ce soit pour les thérapies autologues ou allogéniques, les étapes sont nombreuses et principalement réalisées de manière manuelle, augmentant les risques d’erreurs et de contaminations. De plus, la mise en place d’outils PAT (Process Analytical Technology), d’instrumentation ou encore d’intégration et d’automatisation est très rare.
Thérapies autologues : des cellules rares, coûteuses et variables
Les thérapies autologues impliquent le prélèvement chez un patient, la réalisation de manipulations ou de transformations, puis la réintroduction des cellules chez ce même patient pour traiter ou prévenir une maladie, un trouble ou un état pathologique.
Par définition, les quantités de cellules obtenues sont donc faibles et leur coût important – 1L de Leukopak peut coûter plusieurs milliers de $ et ne contient qu’un nombre limité de cellules !
Une grande partie de l'optimisation est effectuée dans des plaques ou des flacons. Les expériences réalisées à une échelle plus proche de la fabrication (1L) sont laborieuses, occupent un espace important au sein du laboratoire et le nombre d’essais possibles à partir d’un seul donneur est restreint.
Thérapies allogéniques – Mise en place difficile de DoE (Design of Experiment)
Au cours des thérapies allogéniques, les cellules souches prélevées chez un donneur sont développées puis différenciées en un type spécifique.
L'expansion des cellules souches nécessite une surveillance constante et une alimentation avec des milieux contenant un mélange complexe de facteurs de croissance et de suppléments.
Le développement d'un procédé de différenciation nécessite l'ajout de différents facteurs de croissance à différents moments sur une période pouvant aller de 10 à 60 jours. Des expériences de type DoE sont nécessaires pour développer un procédé de différenciation optimisé mais ces études sont souvent réalisées dans des boîtes à 6 puits, ne permettant pas un niveau de contrôle et d'alimentation optimum.
Réaliser un DoE à plus grande échelle nécessite un nombre initial plus élevé de cellules souches et les coûts de milieux peuvent rapidement devenir prohibitifs (1 000 $/L voire plus).
Avec une dynamique en pleine croissance, soutenue depuis 2021 en France par le gouvernement au travers d’une stratégie d’accélération des « Biothérapies et bioproduction de thérapies innovantes » dans le cadre du Plan « France Relance », il devenait urgent pour les fournisseurs de mettre à disposition des équipes de recherche, des technologies permettant de répondre aux différentes problématiques que soulèvent le développement des médicaments innovants.
C’est à présent chose faite !
Comment la miniaturisation, automatisée et contrôlée, des procédés de thérapies cellulaires répond-elle à ces problématiques ?
La miniaturisation des systèmes génère 2 bénéfices immédiats liés :
- la réduction des volumes utilisés et
- la réalisation possible de plus d’expériences à partir du même matériel biologique/prélèvements de cellules.
Réduction des volumes et augmentation de la connaissance
Le développement d’une plateforme de microbioréacteurs de 2 mL, contrôlés et activés par perfusion, permet de développer et surtout d’optimiser un procédé de thérapie cellulaire ou génique.
Le faible volume requis permet de réaliser plus d’expériences et de générer un grand nombre de réplicas à partir d’une même quantité limitée d’échantillons (Leukopaks) : jusqu'à 50 x plus de runs de développement possibles !
La technologie du système permet également de réaliser des cultures à haute densité.
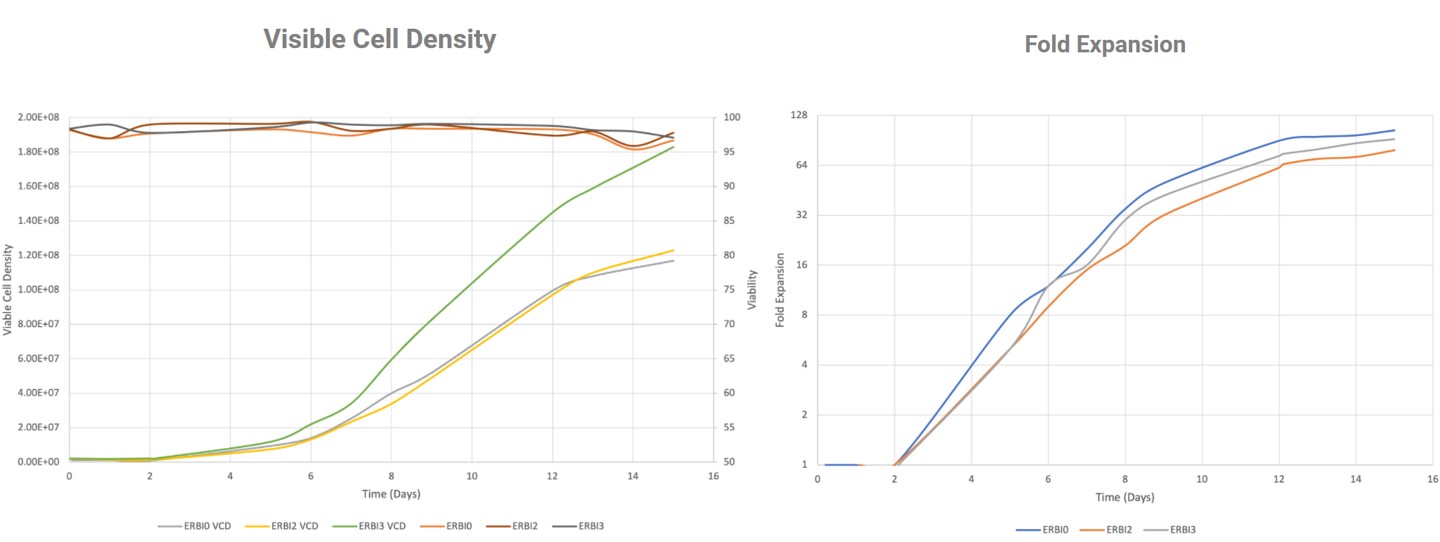
Exemple avec une culture de lymphocytes T
+ 180 millions de cellules/mL, extension 100X, rapport CD4/CD8 maintenu, qualité reproductible maintenue
Multiplication des systèmes en parallèle et augmentation de la connaissance
La réduction des volumes des systèmes et leur très faible encombrement – il est possible de réaliser 4 cultures sur une surface de seulement 0.1 m2 ! – permet de pouvoir multiplier les systèmes et leur utilisation en parallèle, simplifiant par exemple la mise en place de DoE (Design of Experiment).
Plus de conditions sont testées, plus de données sont générées permettant de caractériser et d’optimiser en un temps record un procédé de fabrication.
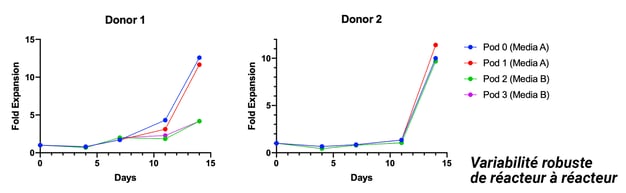
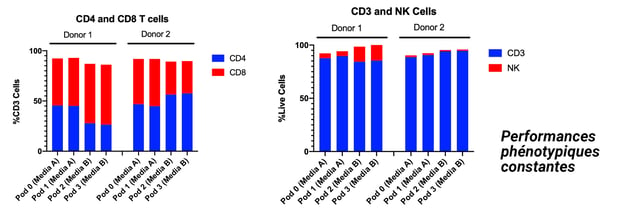
Exemple avec la reproductibilité des donneurs à travers la croissance et le phénotype à partir de différents milieux
Plusieurs réplicas réalisés à partir d'une seule source, plusieurs runs avec différents milieux et suppléments, répétabilité du procédé sur plusieurs runs, expansion des lymphocytes T à des densités de 100 M/mL
Utilisation simplifiée, automatisation et flexibilité
Les microbioréacteurs sont livrés stériles, prêts à l’emploi avec le système de distribution des liquides et le filtre de perfusion intégrés. Une fois réceptionné, la mise en place est rapide et simple, permettant là encore de gagner du temps.
Le procédé est entièrement configuré et géré depuis le logiciel intégré, avancé et intuitif, où il est possible d’exécuter de manière autonome des stratégies de contrôle sophistiquées en plusieurs étapes, des changements de milieux ou encore des concentrations cellulaires.
Ainsi, les limitations passées sur les procédés de médicaments innovants sont aujourd’hui levées, offrant des possibilités gigantesques pour le développement de ces procédés et la médecine de demain.