L'utilisation de la capacitance pour mesurer la densité cellulaire en ligne n'est pas nouveau. Initialement, la technologie a été développée il y a plus de 30 ans (1) pour la détermination de la biomasse en suspension. Elle est depuis largement utilisée dans les sociétés biopharmaceutiques et biotechnologiques dans le monde entier.
La mesure de capacitance est devenue une technologie standard pour la surveillance et l'automatisation des cultures cellulaires, des laboratoires R&D aux procédés de production à grande échelle de produits biologiques ou de vaccins.
Que mesure la capacitance et comment est-elle liée à la densité et à la santé des cellules ?
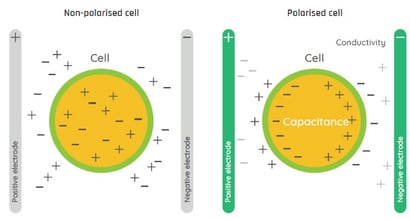
Une cellule en suspension possède une membrane externe constituée d'une bicouche imperméable aux ions et non conductrice. Le milieu de culture est un ensemble de nombreux composants comprenant notamment des ions en suspension. Lorsqu’un champ électrique est appliqué, une cellule vivante, à la membrane intacte, se polarise et agit comme un condensateur pour stocker l'énergie électrique. À mesure que le nombre et le volume des cellules augmentent, le nombre de membranes cellulaires polarisées augmente faisant augmenter la capacitance. Cette dernière est donc directement proportionnelle au volume total lié à la membrane des cellules. Les cellules mortes ayant des membranes cellulaires discontinues, les particules solides et les bulles de gaz n’ayant pas de membranes, ne peuvent pas stocker de charge électrique et ne contribuent pas à la capacitance dans une suspension cellulaire.
La mesure de la capacitance reflète donc uniquement la densité et la taille des cellules vivantes, le biovolume viable.
Comment comparer la capacitance aux autres mesures at-line et off-line ?
Est-il justifié d'utiliser ses données brutes pour surveiller la densité et la santé des cellules ?
Mesures at-line et off-line de la densité cellulaire
Différentes méthodes at-line ou off-line sont utilisées pour mesurer la densité cellulaire en utilisant la concentration de cellules viables (VCC) comme indicateur de performance clé (KPI).
Les méthodes les plus courantes sont répertoriées ci-dessous.
|
Méthodes |
Exemples de technologies |
Limitations |
|
Exclusion du colorant bleu Trypan Analyse les cellules par couleur : les cellules vivantes sont incolores, les cellules mortes sont colorées en bleu. |
Cedex Bio® Analyzer (Roche) Vi-CELL BLU Cell Viability Analyzer (Beckman-Coulter Life Sciences) |
Longtemps considérée comme la référence en matière de biotraitement pour mesurer la VCC. Actuellement débat parmi les experts en procédés sur une surestimation des valeurs VCC obtenues (2). |
|
Détection de particules Mesure les particules par détection de zone électrique. Ne différencie pas les cellules vivantes des cellules mortes. |
Multisizer 4e Coulter Counter (Beckman- Coulter Life Sciences) |
Ne permet pas de faire la différence entre cellules vivantes et mortes. Peut également montrer une certaine distorsion des données si l'échantillon contient des débris cellulaires importants ou des agrégats cellulaires. |
|
Cytométrie en flux Analyse les cellules par fluorescence. Les cellules vivantes émettent une fluorescence rouge à faible longueur d'onde, les cellules mortes une fluorescence rouge à longueur d'onde élevée. |
Guava® easyCyte ™ (Merck) |
Comme pour la méthode d'exclusion de colorant, selon certains experts, il existe un risque de surestimer la VCC (2). |
Les défis des mesures at-line et off-line
Les mesures at-line et off-line ne sont pas toujours optimales pour surveiller la santé et la densité des cellules :
- Elles impliquent un échantillonnage réduisant le volume dans le bioréacteur, la fréquence des prélèvements est alors réduite et ne se fait qu'à des intervalles de 12 à 24 heures. Ces méthodes ne permettent pas de produire une cartographie détaillée du procédé ou de fournir des données opportunes pour un retour d'information afin de le contrôler.
- Les échantillons sont retirés physiquement pas un technicien ou un préleveur automatique, nécessitant du temps et pouvant également introduire des erreurs de mesures, des variations ou encore des risques de contamination.
Les avantages d'une surveillance de la densité et de la santé des cellules à l'aide de la capacitance
Une mesure en ligne
L’avantage principal de la mesure de capacitance est qu’il s’agisse d’une technique PAT (Process Analytical Technology) en ligne. Elle est considérée par les experts en bioprocédés comme la méthode en ligne la plus précise et la plus cohérente pour surveiller la densité des cellules vivantes dans des cellules mammifères (2,3). Les sondes FUTURA d'Aber, par exemple, peuvent produire un signal toutes les secondes, en ligne, permettant de produire une cartographie détaillée des paramètres de procédés critiques (CPP) et des indicateurs de performance clés (KPI) pouvant être utilisés ensuite pour un rétrocontrôle automatisé sans aucun échantillonnage.
Le développement d'une empreinte capacitive peut s’avérer utile également lors d’un procédé en cours afin de pouvoir déterminer plus rapidement si les CPP et les KPI se trouvent en dehors des spécifications acceptables. Cela permet de déclencher une réponse manuelle ou automatisée afin de corriger les écarts et économiser un lot de production coûteux par exemple.
Une mesure pour tous les bioréacteurs et toutes les échelles
La technologie de mesure de capacitance est évolutive (4) et est disponible pour tous les types de bioréacteurs, des plus petits en verre aux plus grands en acier inoxydable. De plus, des capteurs à usage unique sont également disponibles et intégrés directement dans des bioréacteurs à usage unique jusqu'à 2000 L (5,6).
Comment surveiller la densité et la santé des cellules à l'aide de la capacitance ?
Dans le biotraitement, de nombreux scientifiques convertissent les données brutes de capacitance en cellules/mL pour plusieurs raisons :
- Valider la technologie par rapport à une méthode de référence,
- De nombreuses stratégies de contrôle sont basées sur des mesures cellulaires off-line en cellules/mL,
- La capacitance n’a pas été utilisée plus tôt dans le développement du procédé.
Conversion de la capacitance en concentration cellulaire vivante (VCC)
Pour convertir la capacitance en une mesure KPI at-line ou off-line telle que la VCC, un étalonnage doit être effectué pour chaque lignée cellulaire. En effet, des études ont montré qu'avec deux lignées cellulaires testées, une méthode off-line génère des valeurs qui peuvent différer des mesures de capacitance en ligne (7). La méthode d'étalonnage couramment utilisée nécessite un prélèvement d’échantillon toutes les 24 heures pour la mesure VCC tout en enregistrant simultanément la mesure de capacitance en pF/cm à l'aide d'un capteur en ligne. L'échantillon est analysé à l'aide d'un système off-line tel qu’un analyseur Cedex Bio® (Roche) pour générer une valeur en cellules/mL. La valeur de capacitance est ensuite tracée en fonction des cellules/mL et la pente de l'équation de cette courbe donne le facteur d'étalonnage. Cette méthode permet de convertir la capacitance en une méthode de référence off-line. Dans quelques rares cas, un écart peut être observé entre la capacitance et la méthode off-line, en particulier en fin de culture.
Pourquoi cette déviation possible ?
Cet écart semble être principalement dû au fait que chacune des méthodes définit différemment les cellules vivantes des cellules mortes. Une étude menée à l'Université du Manitoba (8) a comparé la détection de particules off-line et at-line, l'exclusion de colorant et la cytométrie en flux fluorescente avec la capacitance en ligne pour surveiller la VCC de cellules CHO cultivées en batch. L'étude a montré que ces techniques produisaient des résultats similaires pendant la phase de croissance exponentielle (80 heures de culture), mais les méthodes d'exclusion de colorant et de détection de particules produisaient des estimations plus élevées de VCC après 80 heures jusqu’à 120 heures. La cytométrie en flux fluorescente a donné des résultats comparables à la capacitance et des tests supplémentaires ont confirmé que ces deux méthodes détectent les cellules apoptotiques qui deviennent non viables plus tôt que les autres méthodes. Cette étude montre que les différentes méthodes de mesure de VCC surveillent différents points de la mort cellulaire.
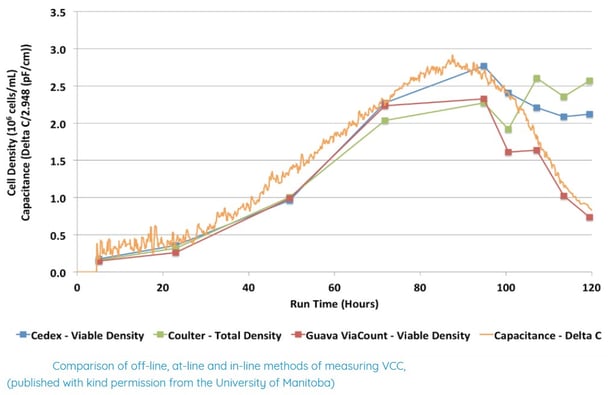
Une autre raison des différences observées repose sur les changements de taille des cellules pouvant affecter les mesures de VCC. Dans une étude menée par Sartorius (5) sur des cellules CHO cultivées pendant 15 jours dans un bioréacteur à usage unique, la capacitance a été comparée à la mesure de VCC à l'aide de la méthode d'exclusion du colorant bleu trypan (Cedex Bio® Analyzer) et la mesure de poids frais. Les résultats montrent que pendant la phase exponentielle (6 jours), les mesures de capacitance sont bien corrélées avec la VCC et le volume de cellules viables (VCV). Cependant, lorsque le diamètre moyen des cellules augmente, les mesures de VCC diffèrent mais la corrélation avec le volume de biomasse calculé est maintenue jusqu'à la fin de la culture. Cela démontre que la capacitance est proportionnelle au volume des membranes cellulaires viables et montre chaque changement de biomasse au cours de la culture.
La capacitance est une méthode précise de surveillance de la biomasse viable.
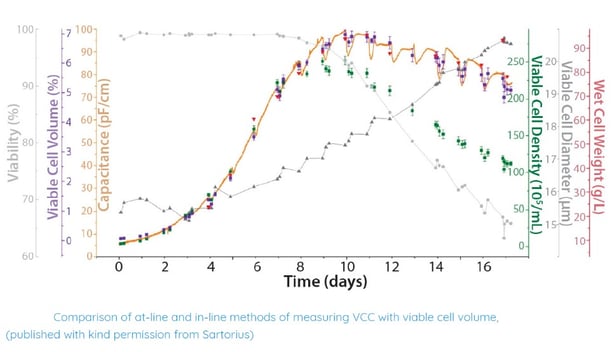
Utilisation de la capacitance brute pour surveiller les cultures
Ces études menées par l'Université du Manitoba et Sartorius montrent que les méthodes at-line et off-line dépendent de la mesure différente de la mort cellulaire. Par conséquent, il est incorrect de dire qu'une méthode de détermination de la santé et de la densité des cellules est plus précise qu'une autre, elles sont simplement différentes et justifient l'utilisation de mesures de capacitance brutes pour suivre la croissance et la viabilité. La capacitance est une représentation plus réaliste de la progression d'une culture car elle peut détecter la mort cellulaire plus tôt. En utilisant cette stratégie, il est possible d’ajuster les paramètres de culture en temps réel en fonction du comportement des cellules. Par exemple, Biogen (9) a montré que l'apoptose peut être inversée en utilisant des informations de capacitance en temps réel, alors que cette mort cellulaire programmée n’était pas détectable suffisamment tôt pour l'inverser en utilisant des mesures de VCC off-line.
L’utilisation des données brutes de capacitance s’avèrent ainsi utile pour les stratégies d'alimentation : les scientifiques peuvent nourrir les cellules en fonction du biovolume viable plutôt que du nombre de cellules.
Depuis 2016, Biogen travaille avec des mesures de capacitance en les comparant à des mesures at-line et off-line. En 2019, la société est passée à l'utilisation de ces mesures comme méthode de référence pour le contrôle des procédés au sein de son usine de production cGMP. L'utilisation des données de capacitance est également explorée pour automatiser la dilution des cultures de semences lors de la mise à l'échelle et comme méthode de prédiction de la demande en glucose (10). Ils utilisent la capacitance brute comme KPI parce que leurs différentes études (10, 11) pour surveiller les cultures de CHO dans des bioréacteurs aux échelles du laboratoire (5L), pilote (200L et 315L) et production (15000L) démontrent que la capacitance fournit des données cohérentes d'un capteur à l'autre sur tous les types et toutes les échelles de bioréacteurs. Avec un coefficient de variance R2 proche de 1 pendant la phase de croissance exponentielle, la capacitance a une bonne corrélation par rapport aux mesures de VCC off-line.
L'utilisation de données de capacitance brutes peut également permettre une stratégie d'alimentation flexible, car les cellules sont alimentées correctement et indépendamment des erreurs de procédés involontaires telles que la sous-inoculation. La preuve en a été démontrée dans 2 études chez Biogen, l'une avec une stratégie d'alimentation automatisée basée sur des mesures de capacitance en ligne et une seconde où la fréquence d'alimentation a été augmentée à toutes les 4 heures (au lieu de 24 heures) en utilisant des données de capacitance en temps réel. La deuxième étude a entraîné une augmentation du titre du produit de 21 %, une diminution de l'épuisement du glutamate dans la culture et une amélioration de la croissance cellulaire. À la suite de ces travaux, Biogen utilise la capacitance comme indicateur de performance clé au lieu de la convertir en VCC pour surveiller ses procédés cGMP.
Utilisation de la conductivité brute pour détecter une contamination
La sonde capacitive Aber mesure également la conductivité en mS/cm. La conductivité est en corrélation avec la concentration d'ions chargés dans une suspension cellulaire. Son utilisation est intéressante pour les contrôles qualité. Une étude récente (13), menée par des chercheurs de l'Université du Massachusetts et de la Food and Drug Administration (FDA), montre que des augmentations inhabituelles de la conductivité mesurées avec une sonde de capacitance dans une culture de cellules CHO était liée à une contamination bactérienne. Cette découverte indique que les mesures de conductivité en ligne peuvent être utilisées pour la détection précoce d’une contamination bactérienne et permettre d'effectuer un dépannage en temps réel en ajoutant des antibiotiques. La possibilité de détecter précocement une contamination bactérienne permet également de minimiser son impact sur les procédés de purification en aval, ainsi que sur les procédures de stérilisation/nettoyage, faisant gagner du temps et des ressources souvent coûteuses, en particulier dans les environnements de fabrication.
Un outil PAT pour le contrôle des procédés
L'utilisation de la mesure de capacitance en ligne permet d’éliminer les problèmes d'échantillonnage et les variations d'analyse de la biomasse associées aux mesures at-line et off-line tout en permettant une surveillance en temps réel des performances d’un procédé.
Son utilisation comme indicateur de performance clé contribue à réduire les coûts et à raccourcir les délais de production, permettant de fournir rapidement des produits biologiques et des vaccins plus abordables.
1. Kell D B. DETERMINATION OF BIOMASS World Patent WO1988002114 (1988)